조기 도입 원하는 유럽 국가별 검토 작업 착수
EMA는 임상 결과 등 토대 '롤링리뷰' 진행중
셀트리온, 신속승인 대비 10만명분 미리 생산
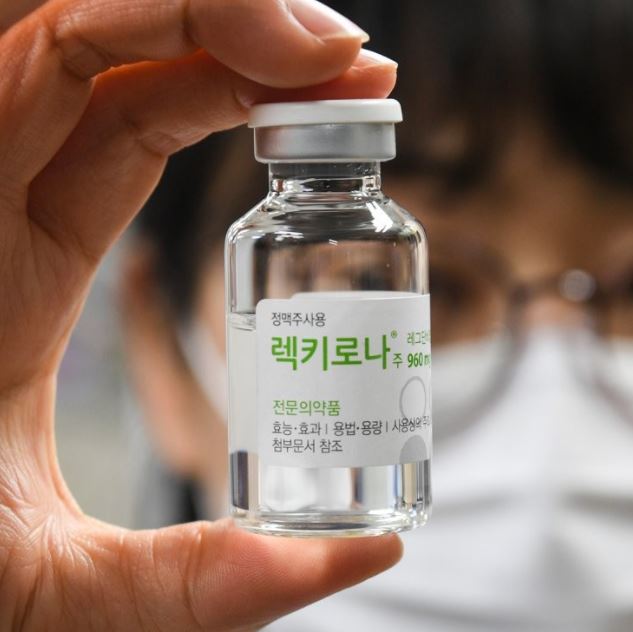
[포쓰저널=조혜승기자] 셀트리온의 코로나19 항체치료제 ‘렉키로나주(개발명:CT-P59, 성분명:레그단비맙)'의 유럽 진출이 임박했다.
3일 셀트리온에 따르면 유럽 의약품청(EMA)은 렉키로나주 조기 도입을 원하는 유럽연합(EU) 소속 개별 국가를 대상으로 전문의견을 제시하는 절차에 들어갔다.
EU 차원의 품목허가와는 별개로 독일, 프랑스, 이탈리아 등 코로나19 상황이 심각한 나라들이 자체 판단에 따라 렉키로나를 조기에 의료현장에 투입할 가능성을 열어 둔 셈이다.
EMA는 지난 달 24일 셀트리온의 임상 결과를 살펴보는 '롤링리뷰'에 착수했는데, 이번 절차는 이와는 별개로 진행된다.
당장 코로나19 치료제 도입이 시급한 EU 내 개별 국가 방역당국이 EMA 품목허가가 나기 전에도 ‘동정적 사용 프로그램’ 등을 통해 도입 결정을 내릴 수 있도록 하는 절차다.
이를 위해 EMA 산하 약물사용자문위원회(CHMP) 소속 전문가 그룹의 렉키로나에 대한 과학적 검토 의견을 각 국가에 제시하는 절차다.
이번 검토는 코로나19 중등증 환자, 입원 위험이 높은 고위험군 환자를 대상으로 진행한 임상시험 데이터를 기반으로 진행된다.
EMA는 렉키로나가 코로나19 치료제로서 중증으로의 악화 비율을 낮추고 집중치료시설 내원 및 입원 비율을 줄일 수 있는지 여부를 검증하고 있다.
셀트리온은 ‘롤링 리뷰’를 통한 렉키로나의 신속한 품목허가를 진행하기 위해 품질 및 제조 공정 관리, 비임상 시험 및 임상시험 데이터를 EMA에 제출한 상태다.
CHMP는 2월 24일부터 셀트리온이 제출한 각종 데이터를 기반으로 렉키로나의 효능 및 안전성 등에 대한 평가를 시작했다.
셀트리온은 EMA 등의 신속 승인에 대비해 렉키로나 물량을 미리 확보해 놓고 있다.
10만명 분을 이미 생산 완료했다.
추가 수요에 따라 연간 150만~300만명 분의 렉키로나를 추가 생산할 계획이다.
국내에서는 2월 17일부터 렉키로나주가 의료현장에 투입돼 코로나19 환자에 투약되고 있다.